2.1.1 Posición del aluminio en sistema periódico y la estructura de su átomo
El aluminio está en el subgrupo principal. Grupo III. La disposición de los niveles de energía es la siguiente:
3 Al 2e - , 8e - ,3e -
Dado que los átomos de aluminio tienen nivel externo 3 electrones, entonces el aluminio en compuestos exhibe un estado de oxidación de 4-3.
Llegamos a la misma conclusión, guiados por ideas sobre la naturaleza del movimiento de los electrones en los átomos y su ubicación no solo en los niveles de energía, sino también en los subniveles. En un átomo de aluminio, los electrones 3s 2 se descomponen fácilmente y un electrón pasa por el orbital 3p:
El resultado son tres electrones desapareados. Responda la pregunta 1 (pág. 138).
2.1.2 Hallazgo de aluminio en la naturaleza, su producción y propiedades
El aluminio es el tercer elemento más abundante en la corteza terrestre. Solo ocurre en compuestos. Los más importantes se muestran en la Figura 19.
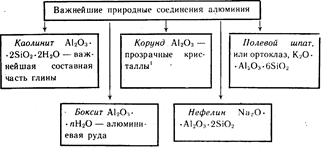
Cristales de Al 2 O 3 de color rojo - rubíes, de color azul- zafiros.
Recibo
El químico alemán F. Wöhler en 1827 obtuvo aluminio calentando cloruro de aluminio con Metales alcalinos potasio o sodio sin acceso al aire.
AlCl 3 +3K 3KCl + Al
Para la producción industrial de aluminio estos métodos no son económicamente viables, por lo que se desarrolló un método electroquímico para producir aluminio a partir de bauxitas.
Aluminio - metal blanco plata, ligero (r \u003d 2,7 g / cm 3), se funde a 660 ° C. Es muy plástico, se dibuja fácilmente en alambre y se hornea en láminas y papel de aluminio. En términos de conductividad eléctrica, el aluminio es superado solo por la plata y el cobre (es 2/3 de la conductividad eléctrica del cobre).
Propiedades químicas
En la serie de voltaje electroquímico, el aluminio se coloca detrás de los metales más activos. Sin embargo, por la experiencia cotidiana se sabe que los productos de aluminio (platos, etc.) no se ven afectados ni por el oxígeno ni por el agua, incluso a su temperatura de ebullición. El aluminio tampoco se ve afectado por el ácido nítrico frío concentrado. Esto se debe a la presencia de una fina película de óxido en la superficie de aluminio, que la protege de una mayor oxidación. Si la superficie del aluminio se frota con sal de mercurio, se produce la siguiente reacción:
2А1 + 3HgCl 2 ® 2А1С1 3 + 3Hg
El mercurio liberado disuelve el aluminio y se forma su aleación con mercurio: amalgama de aluminio. La película no se retiene en la superficie amalgamada, por lo que el aluminio reacciona con el agua cuando condiciones normales(Fig. 46):
2А1 + 6НОН ® 2А1(ОН) 3 ¯ + 3Н 2
A temperatura elevada el aluminio reacciona con muchos no metales y sustancias complejas sin amalgamarse:

Solicitud
El aluminio se utiliza para la producción de diversas aleaciones. Los más extendidos son los duraluminios que contienen cobre y magnesio, y los siluminosos, aleaciones de aluminio con silicio. Las principales ventajas de estas aleaciones son la ligereza y la alta resistencia. Las aleaciones mencionadas se utilizan ampliamente en la fabricación de aviones, automóviles, barcos e instrumentos, en la tecnología de cohetes y en la construcción. En forma de metal puro, el aluminio se utiliza para la fabricación de cables eléctricos y diversos equipos químicos.
El aluminio también se utiliza para aluminizar, es decir, saturar las superficies de los productos de acero y hierro fundido con aluminio para protegerlos de la corrosión.
En la práctica, a menudo se usa termita (una mezcla de óxido de Fe 3 O 4 con polvo de aluminio). Si esta mezcla se prende fuego (con una cinta de magnesio), se produce una reacción violenta con la liberación de una gran cantidad de calor:
8Al + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
Este proceso se utiliza en la llamada soldadura por termita, así como para obtener algunos metales en forma libre.
Conteste las preguntas 2-6 (pág. 138). Resolver los problemas 1 - 2 (pág. 138).
2.1.3 Los compuestos de aluminio más importantes
Óxido de aluminio
El Al 2 O 3 se puede obtener de las siguientes formas:
1. Por combustión directa de polvo de metal de aluminio (soplando polvo de aluminio en la llama del quemador):
4Al + 3O 2 ® 2A1 2 O 3
2. Por transformación según el siguiente esquema:
El óxido de aluminio es una sustancia sólida, refractaria (temp. pl. 2050 ° C) el color blanco.
Según sus propiedades químicas, es un óxido anfótero (I, § 37). Reacciona con ácidos, exhibe las propiedades de los óxidos básicos:
A1 2 O 3 + 6HC1 2A1C1 3 + 3H 2 O
Al 2 O 3 + 6H + + 6С1 - 2Al 3+ + 6С1 - + 3Н 2 O
A1 2 O 3 + 6H + 2A1 3+ + 3H 2 O
El óxido de aluminio reacciona con los álcalis y exhibe las propiedades de los óxidos ácidos. Además, durante la fusión se forman sales de metaaluminio ácido HA1O 2, es decir, metaaluminatos:
Al 2 O 3 + 2NaOH 2NaA10 2 + H 2 0
En presencia de agua, la reacción procede de manera diferente:
A1 2 O 3 + 2NaOH + H 2 O ® 2
Esto se debe al hecho de que, en una solución acuosa, el aluminato de sodio NaA1O 2 se une a una o dos moléculas de agua, que se pueden representar de la siguiente manera:
a) NaA1O 2 -H 2 O, o NaH 2 A1O 3; b) NaA1O 2 -2H 2 O, o NaAl (OH) 4.
hidróxido de aluminio
El hidróxido de aluminio A1 (OH) 3 se obtiene haciendo reaccionar una solución alcalina con soluciones de sales de aluminio (no se puede tomar una solución alcalina en exceso):
AlCl 3 + NaOH ® Al(OH) 3 ¯ + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al(OH) 3 ¯ + 3Na + + 3С1 -
Al 3+ + 3OH - ® A1 (OH) 3 ¯
Si la masa gelatinosa blanca de hidróxido de aluminio se aísla de la solución y se seca, se obtiene una sustancia cristalina blanca que prácticamente no se disuelve en agua.
El hidróxido de aluminio (como su óxido) tiene propiedades anfóteras. Como todas las bases, el hidróxido de aluminio reacciona con los ácidos. Cuando el hidróxido de aluminio se fusiona con álcalis, se forman metaaluminatos, y en soluciones acuosas- hidratos de metaaluminatos:
А1(OH) 3 + NaOH NaА1O 2 + 2Н 2 O
A1 (OH) 3 + NaOH ® NaH 2 A1O 3 + H 2 O
Las sales de aluminio se obtienen principalmente por la interacción del aluminio metálico con ácidos. Según sus propiedades físicas, se trata de sustancias sólidas cristalinas, fácilmente solubles en agua. Las propiedades químicas de las sales de aluminio son similares a las de otras sales (, pp. 98-99). Dado que las sales de aluminio están formadas por una base débil y un ácido fuerte, se hidrolizan en soluciones acuosas (pág. 18).
Responda las preguntas 7-10 (pág. 138). Resuelve el problema 3 (pág. 138).
Relación genética entre el aluminio y sus compuestos más importantes (Esquema 20).
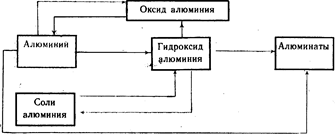
Así, de lo anterior, se puede concluir que currículum escolar se dedican muy pocas horas al estudio de este tema y, aparte de esto, prácticamente no hay información sobre los aspectos ambientales de este tema.
El nitrógeno forma una serie de óxidos que corresponden formalmente a todos los estados de oxidación posibles de +1 a +5: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5, sin embargo, solo dos de ellos son óxido nítrico ( II) y el óxido de nitrógeno (IV) no solo son estables en condiciones normales, sino que también participan activamente en los ciclos naturales e industriales del nitrógeno.
2.2.1 Algunos compuestos nitrogenados y sus propiedades 1.2.1.1. oxido de nitrógeno
N 2 +1 O - óxido nítrico (I), óxido nitroso, gas "hilarante", óxido que no forma sal. Obtener N 2 O por descomposición de nitrato de amonio:
N 2 O tiene una débil olor agradable y sabor dulce. No reacciona con oxígeno, agua, soluciones de ácidos y álcalis. Se descompone en elementos a temperaturas superiores a los 500 °C, es decir, es bastante estable.
Estructura: el oxígeno tiene 2 electrones desapareados, el nitrógeno tiene 3: se forma un doble enlace y un electrón desapareado en el resto. Se puede suponer que las moléculas de NO se emparejarán y formarán una molécula ONNO dimérica. Estructura de la molécula: molécula lineal O=N=N, en la que el átomo de N central es tetravalente. Forma dos dobles enlaces: uno con el oxígeno según el esquema típico para crear un enlace covalente (dos electrones de nitrógeno, dos electrones de oxígeno), el otro con un átomo de nitrógeno (que aparea dos de sus tres electrones desapareados y forma un orbital vacío debido a esto), uno de los enlaces es covalente, el segundo es donante-aceptor (Fig. 1).
La instalación para la producción de óxido nítrico (I) consta de gradillas, probetas, tapón con tubo de salida de gas, cristalizador, cilindro y lámpara de alcohol (Fig. 2). Se coloca NH 4 NO 3 en un tubo de ensayo, se cierra con un tapón con un tubo de salida de gas y se calienta. El gas se recoge en un cilindro lleno de agua.

Arroz. 1. Molécula de óxido nítrico (I) - N 2 O
El óxido N 2 O se descompone cuando se calienta:
El óxido N 2 O reacciona con el hidrógeno:
N +2 O - óxido nítrico (II), óxido que no forma sal. El NO se obtiene por la reacción del cobre con ácido HNO 3 (dif.) (Fig. 3).
celda de cristal molecular; la molécula es ligera, débilmente polar (la electronegatividad del oxígeno es ligeramente superior a la del nitrógeno). Se puede suponer que los puntos de fusión y ebullición serán bajos, pero superiores a los del nitrógeno, ya que la polaridad de la molécula permite relacionar las fuerzas de atracción electrostáticas con fuerzas intermoleculares simples. La formación de un dímero también contribuye a un aumento en el punto de ebullición. La estructura de la molécula también sugiere una baja solubilidad en agua. El óxido nítrico (II) es incoloro e inodoro.
Para obtener el óxido nítrico (II), se colocan unas virutas de cobre en un tubo de ensayo y se vierte ácido nítrico diluido. El tubo de ensayo se cierra con un tapón con un tubo de salida de gas y se fija en un trípode. Final tubo de gas se baja al cristalizador con agua y luego al cilindro (Fig. 3). Cuando se calienta, se libera NO. El NO se oxida fácilmente con el oxígeno del aire, es decir, actúa como agente reductor:
![]()
En la reacción con dióxido de azufre, el óxido de NO es un agente oxidante:
![]()
N +2 2 O 3 - óxido nítrico (III), anhídrido nitroso (corresponde al ácido nitroso HNO 2 y sales de nitrito); es un óxido ácido, tiene todas las propiedades de los óxidos ácidos. Obtener óxido N 2 O 3 por la reacción:
NO 2 + NO N 2 O 3.
N +4 O 2 - óxido nítrico (IV), dióxido de nitrógeno, gas marrón (tóxico).
Considere los electrones de nitrógeno en la molécula de NO. Este es un electrón desapareado. pareja libre electrones y dos electrones más en enlace con el oxígeno - un total de cinco. Y el átomo de oxígeno, "entrando en contacto", tiene seis electrones en cuatro orbitales. Si los organiza de dos en uno, un orbital permanecerá libre. Es este espacio el que está ocupado por un par de electrones del átomo de nitrógeno (Fig. 4, 5).
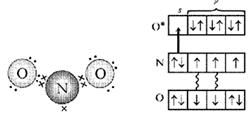
Arroz. 4. Esquema de la estructura electrónica de la molécula de NO 2 (primera versión). (Los puntos indican los electrones de los átomos de O, las cruces indican los electrones del átomo de N)
Arroz. 5. Esquema de la estructura electrónica de la molécula de NO 2 (segunda versión). (El asterisco indica el átomo de O excitado, la flecha indica el enlace donante-aceptor.
Dado que un par de electrones ubicados en el orbital s "se conectaron", simplemente debe someterse a hibridación. Surge la pregunta: ¿qué tipo de hibridación utiliza el átomo? Respuesta: tres orbitales electrónicos de nitrógeno están en un estado de hibridación sp 2. La molécula de NO 2 es angular, el ángulo es de 134° (el ángulo es mayor de 120° porque 1 electrón repele los electrones de enlace más débiles que un par de electrones) (Fig. 6, 7).
Sin embargo, la red cristalina es molecular, dado que la molécula en sí es más pesada que el NO y su tendencia a la dimerización es notablemente mayor, entonces esta sustancia debería fundirse y hervir a una temperatura notablemente mayor. altas temperaturas. El punto de ebullición es de 21 ° C, por lo tanto, en condiciones normales, 20 ° C y 760 mm Hg. Arte. – óxido nítrico (IV) líquido.
El óxido nítrico (IV) se disuelve en agua, reaccionando simultáneamente con él, y en este caso se obtienen dos ácidos a la vez.


Arroz. 6. Molécula de NO 2 - vista superior
Arroz. 7. Molécula de NO 2 - vista lateral, desde el lado del enlace donante-aceptor. (El segundo átomo de oxígeno no es visible más allá de los orbitales del átomo de nitrógeno. Los círculos sombreados son los orbitales atómicos hibridados que apuntan hacia el lector).
El óxido nítrico (IV) también tiene una característica Olor fuerte, y un color marrón rojizo, cuyos tonos difieren entre sí según la concentración. Es por este color que las emisiones de óxidos de nitrógeno a la atmósfera se denominan "colas de zorro".
Reacciones de óxido de NO 2
1) Con agua:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2.
2) Con álcalis:
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O.
3) Dimerización al enfriar:
![]()
A una temperatura de -11 °C, el equilibrio está completamente desplazado hacia la derecha ya +140 °C está completamente hacia la izquierda.
N +5 2 O 5 - óxido nítrico (V), anhídrido nítrico, óxido de ácido, agente oxidante fuerte. El óxido N 2 O 5 se descompone fácilmente:
2N 2 O 5 \u003d 4NO 2 + O 2.
2.2.1.2 Ácido nítrico
De los hidróxidos de nitrógeno, consideraremos el de mayor tonelaje: el ácido nítrico.
La molécula de ácido nítrico es polar (debido a la diferente electronegatividad del oxígeno y del hidrógeno, porque el nitrógeno está, por así decirlo, escondido dentro de la molécula) y asimétrica. Los tres ángulos presentes en él entre los enlaces de nitrógeno y oxígeno son diferentes. El estado de oxidación formal del nitrógeno es el más alto (+5). Pero al mismo tiempo, solo hay 4 enlaces en el átomo de nitrógeno con otros átomos: la valencia del nitrógeno es 4.
La estructura de una molécula es más fácil de entender si consideramos el proceso de obtención de la misma. El ácido nítrico se obtiene por la reacción del óxido nítrico (IV) con agua (en presencia de oxígeno): dos moléculas de NO 2 simultáneamente "atacan" a la molécula de agua con sus electrones desapareados, como resultado, el enlace entre el hidrógeno y el oxígeno es no se rompe como de costumbre (un par de electrones en oxígeno y "protones desnudos"), y una molécula de NO 2 obtiene hidrógeno con su electrón, la otra, el radical OH (Fig. 8). Se forman dos ácidos: ambos ácidos son fuertes, ambos donan rápidamente su protón a las moléculas de agua más cercanas y finalmente permanecen en forma de iones NO 2 y NO 3. El ion NO 2 es inestable, dos moléculas de HNO 2 se descomponen en agua, NO 2 y NO. El óxido de NO reacciona con el oxígeno, convirtiéndose en NO 2, y así sucesivamente hasta obtener únicamente ácido nítrico.
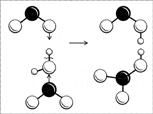
Arroz. 8. Esquema de formación de moléculas de ácidos nítrico y nitroso. (La bola negra es el átomo de N, las bolas blancas grandes son los átomos de O, las bolas blancas pequeñas son los átomos de H).
Formalmente, resulta que un átomo de nitrógeno está conectado con un átomo de oxígeno por un enlace doble, y con otro, por un enlace simple ordinario (este átomo de oxígeno también está conectado a un átomo de hidrógeno). El nitrógeno en el HNO 3 está unido al tercer átomo de oxígeno por un enlace donante-aceptor, con el átomo de nitrógeno actuando como donante. La hibridación del átomo de nitrógeno en este caso debería ser sp 2 debido a la presencia doble enlace, que define la estructura - un triángulo plano. En realidad, resulta que, de hecho, un fragmento de un átomo de nitrógeno y tres átomos de oxígeno es un triángulo plano, solo que en una molécula de ácido nítrico este triángulo es incorrecto: los tres ángulos ONO son diferentes, por lo tanto, y lados diferentes triángulo. Cuando la molécula se disocia, el triángulo se vuelve regular, equilátero. Esto significa que los átomos de oxígeno en él se vuelven equivalentes. Todas las conexiones se vuelven iguales.
Propiedades físicas del ácido nítrico
Un compuesto ionizado, aunque solo sea parcialmente, es difícil de convertir en gas. Por lo tanto, el punto de ebullición debería ser lo suficientemente alto, pero con un peso molecular tan pequeño, el punto de fusión no debería ser alto. Por tanto, el estado de agregación a 20°C es líquido. Con respecto a la solubilidad, como muchos otros líquidos polares, el ácido nítrico se mezcla fácilmente con agua en cualquier proporción. El ácido nítrico puro es incoloro e inodoro. Sin embargo, debido a la descomposición en oxígeno y óxido nítrico (IV), que se disuelve en él, podemos decir que el ácido nítrico concentrado ordinario tiene un color marrón amarillento y un olor acre característico del NO 2. Veamos cómo la estructura de la molécula de ácido nítrico afecta su Propiedades químicas.
HNO 3 es un agente oxidante fuerte
Cuando el HNO 3 interactúa con los metales (M), no se libera hidrógeno:
M + HNO 3 ® sal + agua + gas.
Una mezcla de HNO 3 (conc.) con HCl (conc.) en una relación de volumen de 1:3 (1V HNO 3 + 3V HCl) se denomina "aqua regia".
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O.
El ácido nítrico no reacciona con otros ácidos en forma de reacciones de intercambio o compuestos. Sin embargo, es bastante capaz de reaccionar como un fuerte agente oxidante. En una mezcla de ácidos nítrico y clorhídrico concentrados, ocurren reacciones reversibles, cuya esencia se puede resumir en la ecuación:

El cloro atómico resultante es muy activo y toma fácilmente electrones de los átomos metálicos, y el ion cloruro forma iones complejos estables con los iones metálicos resultantes. Todo esto permite que incluso el oro se transfiera a la solución. El H 2 SO 4 concentrado como fuerte agente deshidratante promueve la reacción de descomposición del ácido nítrico en óxido nítrico (IV) y oxígeno. El ácido nítrico es uno de los ácidos inorgánicos fuertes y reacciona naturalmente con los álcalis. También reacciona con hidróxidos insolubles y óxidos básicos.
Al estudiar el tema “Nitrógeno. Compuestos de nitrógeno” utiliza el libro de texto de química editado por G.E. Rudzitis, F.G. Feldman, también un libro de texto para el grado 9, editado por N.S. Akhmetov. Material didáctico sirve como un libro de química para los grados 8-9, editado por A. M. Radetsky, V. P. Gorshkov; Se utilizan tareas para el trabajo independiente en química para el grado 9, editado por R.P. Surovtseva, S.V. Sofronova; una colección de problemas en química se utiliza para escuela secundaria y para aspirantes a universidades, editado por G.P. Khomchenko, I. G. Khomchenko. Se asignan 7 horas para el estudio de este tema.
CAPÍTULO 3 Grupo III-A 3.1.1 Boro 3.1.1.1 Distribución en la naturaleza
El boro nunca se encuentra en la naturaleza en estado libre, siempre resulta estar asociado con el oxígeno. De esta forma, está presente en el ácido bórico H 3 BO 3, que se encuentra en las aguas termales de las zonas volcánicas. Además, numerosas sales de ácido bórico son comunes en la naturaleza. De estas sales, la más conocida es la de bórax o tincal Na 2 B 4 O 7 . 10H 2 O. Boracite 2Mg 3 B 8 O 15 es de importancia técnica. MgCl 2, pandermita Ca 2 B 6 O 11. 3H 2 O, colemanita Ca 2 B 6 O 11. 5H 2 O, kernita Na 2 B 4 O 7. 4H2O
Es necesario indicar los siguientes minerales, que son derivados del ácido bórico: borocalcita CaB 4 O 7. 4H 2 O, boro-natrocalcita NaCaB 5 O 9. 6H 2 O, hidroboracita MgCaB 6 O 11. 6H 2 O, boromagnesita 2Mg 5 B 4 O 11. 5H 2 O, singalita MgAlBO 4 y otros.
3.1.1.2 Función bioquímica
El boro y sus compuestos tienen gran importancia en la economía nacional. El isótopo 5 10 B, que absorbe neutrones, se utiliza en la tecnología nuclear para ralentizar las reacciones nucleares en cadena. Bura y ácido bórico Durante mucho tiempo se ha utilizado en medicina como antiséptico.
La actividad fisiológica y biológica del boro es muy elevada. El boro puede influir en los procesos más importantes de la bioquímica de animales y plantas. Junto con Mn, Cu, Zn y Mo, el boro es uno de los cinco elementos vitales oligoelementos importantes. El boro se concentra en huesos y dientes, músculos, médula ósea, hígado y glándula tiroides. Es probable que acelere el crecimiento y desarrollo de los organismos. Esto se puede ver por el efecto del boro en las plantas. Con la falta de boro, el rendimiento y especialmente el número de semillas se reducen significativamente. Para la vida de los animales es importante encontrarlo en la leche (vaca) y en la yema huevos de gallina. Algunas plantas (hierbas forrajeras y remolacha azucarera) recogen varios gramos de boro por hectárea de terreno. El boro se encuentra en cantidades significativas en los tejidos grasos de algunos animales que pastan en pastos enriquecidos con boro. Se desconoce la composición de los compuestos de boro en el cuerpo. Se ha establecido que el boro inhibe la amilasa intestinal y las proteinasas intestinales, potencia la acción de la insulina e inhibe la oxidación de la adrenalina, debilita las vitaminas B 2 y B 12. Con un exceso de boro, aparece enteritis bórica. El exceso de contenido de boro provoca enfermedades en las plantas. El trigo y la avena sufren en presencia de 0,7 - 0,8 mgV/kg de suelo. La lucha contra la salinización del suelo con boro se realiza mediante el lavado de suelos bóricos.
Y fundamentos didacticos la organización de la capacitación permite explicar más fácilmente el material que se estudia en las lecciones de física cuando se estudia el tema "Fundamentos de electrodinámica". Análisis diversas tecnologías hizo posible elaborar una tecnología de autor para desarrollar el enfoque de los estudiantes en la comunicación dialógica en una forma de educación grupal. De qué tan correctamente se construirá el proceso de aprendizaje al usar ...
Con esto, se hace necesario considerar el tema de la relación entre física molecular y química en un curso de secundaria. En el estudio de la física molecular, su relación con la química se manifiesta en dos direcciones principales. El primero de ellos es utilizar los conocimientos de los estudiantes obtenidos en el proceso de estudio de la química como material para probar las principales disposiciones de la física molecular. Segundo...
DEFINICIÓN
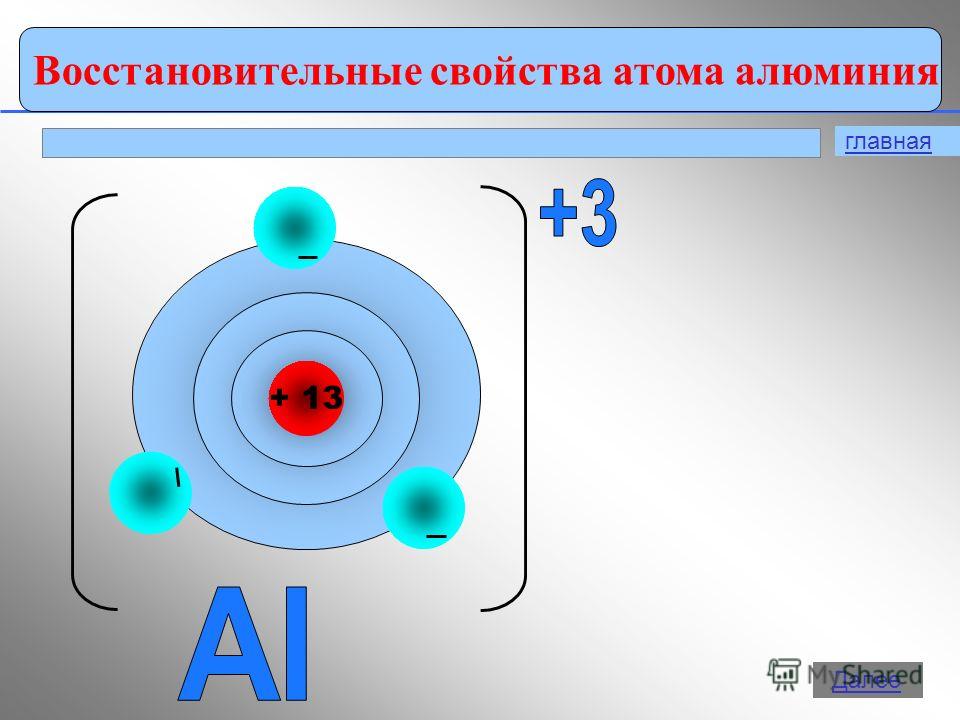
Aluminio ubicado en el tercer período, grupo III del subgrupo principal (A) de la Tabla Periódica. Este es el primer elemento p del tercer período.
Metal. Designación - Al. Número ordinal - 13. Masa atómica relativa - 26.981 a.m.u.
La estructura electrónica del átomo de aluminio.
El átomo de aluminio consta de un núcleo cargado positivamente (+13), en cuyo interior hay 13 protones y 14 neutrones. El núcleo está rodeado por tres capas, a lo largo de las cuales se mueven 13 electrones.
Arroz. 1. Representación esquemática de la estructura del átomo de aluminio.
La distribución de electrones en los orbitales es la siguiente:
13Al) 2) 8) 3;
1s 2 2s 2 2pags 6 3s 2 3pags 1 .
En el exterior nivel de energía el aluminio tiene tres electrones, todos los electrones del tercer subnivel. El diagrama de energía toma la siguiente forma:
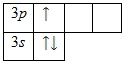
Teóricamente, un estado excitado es posible para un átomo de aluminio debido a la presencia de un 3 vacante d-orbitales. Sin embargo, electron depairing 3 s- el subnivel en realidad no ocurre.
Ejemplos de resolución de problemas
EJEMPLO 1
3 principal Describa el elemento insertando las palabras que faltan 1.Aluminio - elemento III grupo, subgrupo principal. 2. La carga del núcleo de un átomo de aluminio es de 13 protones en el núcleo de un átomo de aluminio. 4. Hay 14 neutrones en el núcleo de un átomo de aluminio. 5. Hay 13 electrones en un átomo de aluminio. 6. Un átomo de aluminio tiene 3 niveles de energía. 7. La capa de electrones tiene una estructura de 2e, 8e, 3e. 8. En el nivel exterior del átomo hay 3 electrones. 9. El estado de oxidación de un átomo en compuestos es igual a La sustancia simple aluminio es un metal. 11. El óxido y el hidróxido de aluminio son de naturaleza anfótera. Más lejos
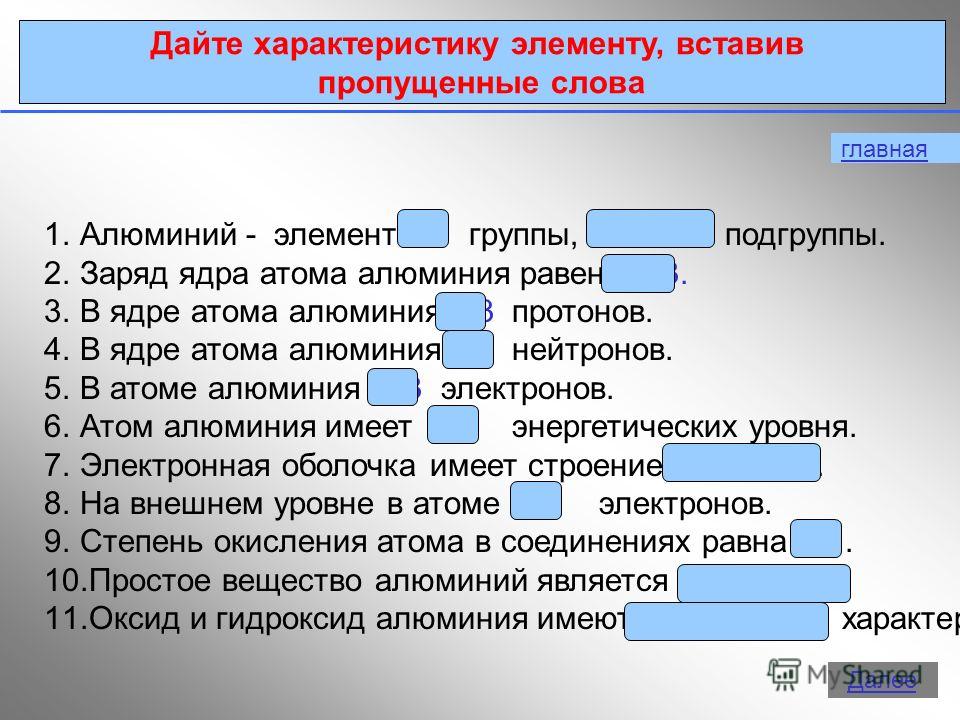
4 Estructura electrónica del átomo 27 AlAl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 Registro electrónico corto 1s21s2 2s22s2 2p 6 3s 2 3p 1 Orden de llenado principal Siguiente

7 De la historia del descubrimiento Inicio Siguiente Durante el descubrimiento del aluminio - el metal fue más caro que el oro. Los británicos querían honrar al gran químico ruso D. I. Mendeleev con un rico regalo, le dieron una balanza química en la que una copa estaba hecha de oro y la otra de aluminio. Una copa de aluminio se ha vuelto más cara que el oro. La "plata de la arcilla" resultante interesó no solo a los científicos, sino también a los industriales e incluso al emperador de Francia. Más lejos



12 1. Metal blanco plateado 2. Brillo metálico 3. El metal más duro 4. Punto de fusión +660 ° C 5. Plástico 6. Fácil de cortar con un cuchillo 7. Conductos electricidad 8. Ligero 9. Conduce el calor 10. Fácil de magnetizar y desmagnetizar 11. Suave Seleccione y anote los números de aquellas propiedades que se relacionan con las propiedades físicas del aluminio




Objetivos de la lección:
Educativo - estudiar las propiedades físicas y químicas del aluminio y sus aplicaciones. Considere las características del elemento químico aluminio y estudie la estructura del átomo.
Desarrollando - desarrollar habilidades para realizar un experimento, transfiriendo el contenido de un texto científico y educativo en forma de diagramas; desarrollo habilidades de comunicación, habilidades de escucha, la capacidad de expresar correctamente sus pensamientos.
Educativo - fomentar una cultura de trabajo con productos quimicos, el cumplimiento de las normas de seguridad, cultivar la disciplina consciente, la claridad y la organización en el trabajo.
Los estudiantes deben saber:
la estructura del átomo de aluminio, las propiedades físicas y químicas del aluminio como sustancia simple, áreas de aplicación.
Los estudiantes deben ser capaces de:
caracterizar el aluminio, tanto un elemento químico como una sustancia simple. Escriba ecuaciones de reacción que prueben las propiedades químicas del aluminio en forma molecular y redox.
Tipo de lección:
aprendiendo material nuevo.
forma de organizacion Actividades de aprendizaje estudiantes:
trabajo en grupo, individual, experimento químico.
Métodos y técnicas de enseñanza:
búsqueda, investigación parcial, experimento químico de demostración, trabajo en grupo, respuestas orales en la pizarra, Trabajo independiente con textos, control mutuo.
Equipo de lección:
textos científicos y educativos sobre el tema de la lección, tarjetas de tareas sobre preguntas separadas del plan para estudiar el material para cada grupo, PSHE,
Colección "Aluminio y sus compuestos", papel de aluminio, ácido clorhídrico e hidróxido de sodio, aluminio, equipo de laboratorio.
El profesor saluda a los alumnos.
2. Actualización de conocimientos básicos, comunicación del tema, tareas y estructura de la lección:
Discurso introductorio del profesor.
Solos, trabajando, haréis todo.
tanto para sus seres queridos como para usted mismo,
y si no hay éxito en el trabajo,
la falla no es un problema, inténtalo de nuevo.
D. I. Mendeleiev.
Seguimos estudiando un gran y tema importante"Rieles". Hoy en la lección tenemos que familiarizarnos con el metal que conoces desde la infancia. Quiero comenzar esta lección con una leyenda.
“Un día, un extraño se acercó al emperador romano Tiberio. Como regalo al emperador, trajo una copa que había hecho de un metal que era tan brillante como la plata, pero extremadamente ligero. El maestro dijo que recibió este metal de Clay Earth. Pero el emperador, temiendo que su oro y su plata se depreciaran, ordenó que le cortaran la cabeza al maestro y que destruyeran su taller. ¿De qué metal estamos hablando?
(Sobre aluminio)
Maestro:
Por lo tanto, el tema de nuestra lección es: "El aluminio es un elemento químico y una sustancia simple".
Se formulan los objetivos de la lección.
Plan para estudiar el tema en grupos:
- Propiedades físicas del aluminio.
- Propiedades químicas del aluminio.
- El uso del aluminio y su presencia en la naturaleza.
Plan de trabajo del grupo:
Estudie el texto y resalte la información relevante para su pregunta;
- completar las tareas propuestas;
- preparar una presentación sobre su tema, basada en la brevedad, la claridad y la claridad de la presentación
Trabajo en grupo sobre el estudio de la materia.
Preparación de una presentación sobre su tema.
Grupo 1.
Características del elemento químico aluminio por su posición en el PSCE.
Ejercicio:
- Mira el texto.
- Dar una descripción del aluminio según la posición en el PSCE según el plano:
A) número de serie.
B) masa atómica.
C) período (pequeño, grande).
D) grupo (subgrupo: principal o secundario).
D) signo químico.
E) La estructura del átomo (carga del núcleo, número de protones, electrones, neutrones, fórmula electrónica).
I) óxidos.
K) Compuestos volátiles de hidrógeno.
2. Discuta los resultados en el grupo y responda las preguntas:
- ¿Cuántos electrones hay en el nivel exterior de un átomo de aluminio?
- ¿El aluminio donará o aceptará estos electrones?
- ¿Qué estado de oxidación adquirirá el ion aluminio en este caso?
- Concluye: ¿A qué clase de compuestos pertenece el aluminio (metal o no metal)?
- Compara la actividad del elemento químico aluminio con elementos de los grupos 1 y 2 del mismo periodo.
- Prepara tu discurso para este problema, establecido sobre la brevedad, la claridad y la claridad de la presentación.
Grupo 2
Propiedades físicas del aluminio.
Ejercicio:
- Mira el texto.
- Resalte el material relevante para su pregunta.
- Considere la colección "Aluminio y sus aleaciones".
- Discutan las siguientes preguntas en un grupo:
- a) Estado del agregado, color, brillo, densidad (ligero o pesado), fusibilidad (fácil o refractario), conductividad eléctrica y térmica, plástico.
- b) Dibujar los datos obtenidos en forma de diagrama.
5. Preparar una presentación sobre el tema, basada en sobre la brevedad y la claridad.
Grupo 3.
Propiedades químicas del aluminio.
Ejercicio:
- Mira el texto.
- Resalte el material relevante para su pregunta.
- ¿Estudiar cómo se comporta el aluminio en relación con las sustancias complejas?
- Complete el laboratorio siguiendo las instrucciones.
Ejercicio:
a) Haz el experimento.
b) Discutir los fenómenos observados en el grupo.
C) Escriba la ecuación de reacción.
D) sacar conclusiones.
5. Preparar una presentación sobre este tema, basado en la brevedad, la claridad y la claridad de presentación.
Grupo 4
El uso del aluminio.
Ejercicio:
- Mira el texto.
- Resalte el material relevante para su pregunta.
- Discutir en grupo siguientes preguntas:
a) ¿Cuál es el papel del aluminio en la vida humana?
b) El uso del aluminio como sustancia simple.
- Haz un diagrama que caracterice el alcance del aluminio.
- Preparar un discurso sobre este tema, basado en la brevedad, claridad y claridad de presentación
- Informe de los grupos sobre los temas estudiados.
Cada grupo, habiendo completado todas las tareas, presenta una presentación esquematizada de su pregunta con discusión y comentarios, los estudiantes toman notas, transfieren los esquemas propuestos a los cuadernos, como resultado de todos los grupos, se elabora un esquema de apoyo en etapas sobre el tema. de la lección
Conclusiones sobre el tema de la lección:
Cuántos electrones hay en el nivel de energía exterior de un átomo de aluminio.
¿Cuál es el número de oxidación de un átomo de aluminio? ¿Por qué? ¿Y el ion?
- ¿Con la ayuda de qué experimentos probamos que el aluminio es un metal activo?
¿Qué sustancias se llaman anfóteras?
¿En qué propiedades se basan? las siguientes áreas aplicaciones?
¿Dónde se encuentra más aluminio en el cuerpo?
- Es posible largo tiempo almacenar alimentos en utensilios de aluminio?
- Tareas para el hogar: § 13 a 60, ? 1, 4. Prepare una presentación sobre el uso del aluminio.
- última palabra maestros
El profesor agradece a los alumnos por su colaboración, marca a los ponentes en el pizarrón.
Referencia.
Aluminio.
El subgrupo principal del grupo III incluye elementos: boro, aluminio, galio, indio, talio. En la capa electrónica externa, los átomos de estos elementos contienen tres electrones (…ns2np1). Son elementos p. En las reacciones, los átomos de estos elementos son agentes reductores, a excepción del boro no metálico, que puede ser un agente oxidante. Todos los elementos de este subgrupo exhiben el grado más alto oxidación +3. Ellos forman óxidos superiores Hidróxidos de E2O3 y E(OH)3, que exhiben propiedades anfóteras. El aluminio es de mayor interés en este subgrupo.
El aluminio en su forma libre es un metal de color blanco plateado, tiene brillo, alta conductividad térmica y eléctrica (inferior al cobre en este aspecto), ligero (densidad 2,7 g/cm3) y al mismo tiempo es un metal duradero. Es un metal suave y dúctil, se puede enrollar en papel de aluminio, se puede estirar en un alambre. Se funde a 6600C. A 6000C, el aluminio se vuelve quebradizo y se puede moler en granos o polvo.
El aluminio es un metal cuya superficie suele estar cubierta con una película de óxido delgada y duradera. En forma de virutas y polvo, arde brillantemente en el aire, liberando un gran número de calor.
A temperatura ambiente reacciona activamente con halógenos, cuando se calienta, interactúa con azufre (2000C), nitrógeno (8000C) y otros no metales.
La proporción de aluminio a sustancias complejas:
El aluminio se disuelve en ácido clorhídrico de cualquier concentración:
El aluminio se disuelve en soluciones alcalinas:
El aluminio juega un papel biológico importante en la vida humana. Participa en la construcción del tejido epitelial y tejidos conectivos. El contenido de aluminio en el cuerpo humano (por 70 kg de peso corporal) es de 61 mg. Se encuentra en todos los órganos y tejidos: sobre todo en el hígado, los pulmones, los huesos del cerebro. La ingesta principal de aluminio en el cuerpo son los alimentos: estos son productos de pan, té (de 20 a 200 mg por 100 g de producto), papas: 4 mg por 100 g. producto, nabo amarillo - 46 mg por 100 g de producto.
Al cocinar y almacenar alimentos en utensilios de aluminio, el contenido de aluminio en los productos se duplica. Un aumento en el contenido de aluminio en la sangre provoca la excitación de la central sistema nervioso. Con un exceso de aluminio en el cuerpo, actividad física, convulsiones, deterioro de la memoria, enfermedades hepáticas y renales. Con una disminución en el contenido de aluminio, se inhibe el sistema nervioso central.
Las áreas de aplicación del aluminio son muy numerosas. Debido a su ligereza y resistencia, el aluminio y sus aleaciones se utilizan en la construcción de aviones y cohetes (el aluminio se denomina metal alado), la construcción de barcos y automóviles; en la construcción: para la fabricación de marcos de ventanas y puertas, la ligereza y la buena conductividad eléctrica del aluminio se utilizan en la fabricación de cables eléctricos para líneas eléctricas. La conductividad térmica y la no toxicidad son importantes en la fabricación de utensilios de cocina de aluminio y láminas de almacenamiento. productos alimenticios. El polvo de aluminio es la base para la fabricación de pintura de plata para proteger los productos de hierro de la corrosión. La capacidad del aluminio para arder en el aire con una llama brillante se usa en la preparación de coloridos fuegos artificiales y en la fabricación de bengalas.
PRESUPUESTO MUNICIPAL INSTITUCIÓN EDUCATIVA
ESCUELA EDUCATIVA GENERAL № 81
Aluminio. La posición del aluminio en el sistema periódico y la estructura de su átomo. Encontrar en la naturaleza. Propiedades físicas y químicas del aluminio.
profesor de química
MBOU escuela secundaria №81
2013
Tema de la lección: Aluminio. La posición del aluminio en el sistema periódico y la estructura de su átomo. Encontrar en la naturaleza. Propiedades físicas y químicas del aluminio.
Objetivos de la lección:
considere la distribución del aluminio en la naturaleza, sus propiedades físicas y químicas, así como las propiedades de los compuestos que forma.
Progreso
1. Momento organizativo de la lección. 2. Aprender material nuevo. Aluminiosubgrupo principal tercero grupos del sistema periódico forman el boro (B), (A l), galio (Ga), indio (In) y talio (T l). Como puede verse en los datos proporcionados, todos estos elementos se abrieron en siglo XIX.Descubrimiento de metales del subgrupo principal
tercero
grupos

A
El boro es un no metal. El aluminio es un metal de transición, mientras que el galio, el indio y el talio son metales completos. Así, con un aumento en los radios atómicos de los elementos de cada grupo del sistema periódico propiedades metalicas sustancias simples intensificar.En esta lección, veremos más de cerca las propiedades del aluminio.1. La posición del aluminio en la tabla de D. I. Mendeleev. La estructura del átomo, los estados de oxidación mostrados. El elemento de aluminio se encuentra en tercero grupo, subgrupo principal "A", 3er período del sistema periódico, número de serie No. 13, masa atómica relativa Ar(Al ) = 27. Su vecino a la izquierda en la tabla es el magnesio, un metal típico, ya la derecha, el silicio, que ya no es un metal. Por lo tanto, el aluminio debe exhibir propiedades de alguna naturaleza intermedia y sus compuestos son anfóteros.Al +13) 2 ) 8 ) 3 , p es un elemento,
Estado básico
1 segundo 2 2 segundo 2 2 pag 6 3 pag 2 3 pag 1
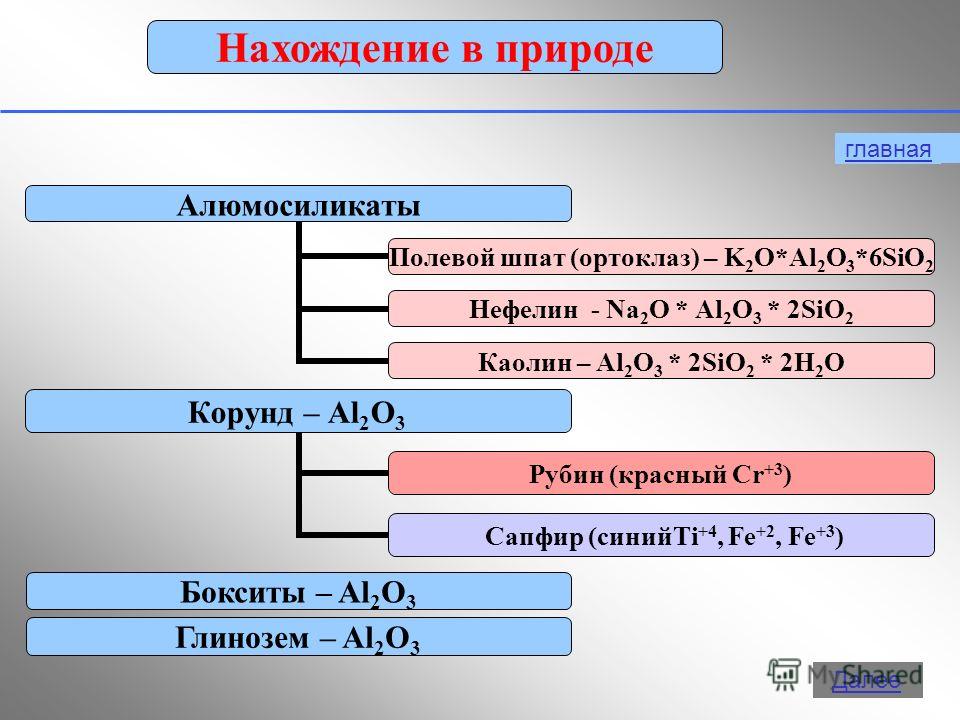
El aluminio exhibe un estado de oxidación de +3 en compuestos: Al 0 - 3 e - → Al +3 2. Propiedades físicas El aluminio de forma libre es un metal blanco plateado con alta conductividad térmica y eléctrica. Punto de fusión 650 sobre C. El aluminio tiene una baja densidad (2,7 g/cm 3 ) - aproximadamente tres veces menos que el hierro o el cobre, y al mismo tiempo es un metal duradero.3. Estar en la naturaleza En términos de prevalencia en la naturaleza, ocupa1° entre los metales y 3° entre los elementos sólo superado por el oxígeno y el silicio. El porcentaje de contenido de aluminio en la corteza terrestre, según varios investigadores, oscila entre el 7,45 y el 8,14 % de la masa de la corteza terrestre.En la naturaleza, el aluminio se presenta sólo en compuestos (minerales). Algunos: Bauxitas - Al 2 O 3 H 2 O (con impurezas SiO 2 , Fe 2 O 3 , CaCO 3 ) Nefelinas - KNa 3 4 Alunitas - KAl(SO 4 ) 2 2Al(OH) 3 Alúmina (mezclas de caolines con arena SiO 2 , piedra caliza CaCO 3 , magnesita MgCO 3 ) Corindón - Al 2 O 3 Feldespato(ortoclasa) - K 2 O×Al 2 O 3 ×6SiO 2 Caolinita - Al 2 O 3 ×2SiO 2 × 2H 2 O Alunita - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3 Berilo - 3BeO Al 2 O 3 6SiO 2Bauxita
4. Propiedades químicas del aluminio y sus compuestos El aluminio interactúa fácilmente con el oxígeno en condiciones normales y se cubre con una película de óxido (le da un aspecto mate).Su espesor es de 0,00001 mm, pero gracias a él el aluminio no se corroe. Para estudiar las propiedades químicas del aluminio, se elimina la película de óxido. (Con ayuda papel de lija, o químicamente: primero sumergiéndolo en una solución alcalina para eliminar la película de óxido, y luego en una solución de sales de mercurio para formar una aleación de aluminio con mercurio, una amalgama).yo . Interacción con sustancias simples. El aluminio ya a temperatura ambiente reacciona activamente con todos los halógenos, formando haluros. Cuando se calienta, interactúa con azufre (200 °C), nitrógeno (800 °C), fósforo (500 °C) y carbono (2000 °C), con yodo en presencia de un catalizador - agua: 2A l + 3 S \u003d A l 2 S 3 (sulfuro de aluminio), 2A l + N 2 \u003d 2A lN (nitruro de aluminio), UN l + PAG = UN l P (fosfuro de aluminio), 4A l + 3C \u003d A l 4 C 3 (carburo de aluminio). 2 Al + 3 I 2 \u003d 2 A lI 3 (yoduro de aluminio)Todos estos compuestos se hidrolizan completamente con formación de hidróxido de aluminio y, en consecuencia, sulfuro de hidrógeno, amoníaco, fosfina y metano: Alabama 2 S 3 + 6 horas 2 O = 2Al(OH) 3 + 3H 2 SAlabama 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3 canales 4 En forma de virutas o polvo, arde brillantemente en el aire, liberando una gran cantidad de calor: 4A l + 3 O 2 \u003d 2A l 2 O 3 + 1676 kJ.
Yo. Interacción con sustancias complejas Interacción con el agua : 2 Al + 6 H 2 O \u003d 2 Al (OH) 3 + 3 H 2 sin película de óxido Interacción con óxidos metálicos: El aluminio es un buen agente reductor, ya que es uno de los metales activos. Está en la serie de actividad inmediatamente después de los metales alcalinotérreos. Es por esorestaura los metales de sus óxidos . Tal reacción, la aluminotermia, se utiliza para obtener metales raros puros, como tungsteno, vanadio, etc. 3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q Termita mezcla Fe 3 O 4 y Al (polvo) - también utilizado en la soldadura por termita. C r 2 O 3 + 2A l \u003d 2C r + A l 2 O 3 Interacción con ácidos : Con solución de ácido sulfúrico: 2 Al + 3 H 2 SO 4 \u003d Al 2 (SO 4) 3 + 3 H 2 No reacciona con concentrados sulfúricos y nitrogenados fríos (pasivados). Por lo tanto, el ácido nítrico se transporta en tanques de aluminio. Cuando se calienta, el aluminio puede reducir estos ácidos sin liberar hidrógeno: 2A l + 6H 2 SO 4 (conc) \u003d A l 2 (SO 4) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (conc) \u003d A l (NO 3) 3 + 3 NO 2 + 3H 2 O. Interacción con álcalis . 2 Al + 2 NaOH + 6 H 2 O \u003d 2 Na Al (OH) 4 + 3 H 2 N / A[PERO yo(ÉL) 4 ] – tetrahidroxoaluminato de sodio Por sugerencia del químico Gorbov, durante la Guerra Ruso-Japonesa, esta reacción se utilizó para producir hidrógeno para globos. Con soluciones salinas: 2 Al + 3 CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu Si la superficie del aluminio se frota con sal de mercurio, se produce la siguiente reacción: 2 Alabama + 3 HgCl 2 = 2 AlCl 3 + 3 hgEl mercurio liberado disuelve el aluminio, formando una amalgama. 5. Aplicación del aluminio y sus compuestos

Las propiedades físicas y químicas del aluminio determinaron su aplicación amplia en tecnologíaLa industria de la aviación es un importante consumidor de aluminio. : 2/3 del avión está hecho de aluminio y sus aleaciones. Un avión hecho de acero sería demasiado pesado y podría transportar muchos menos pasajeros.Por lo tanto, el aluminio se llama el metal alado. Los cables y alambres están hechos de aluminio. : con la misma conductividad eléctrica, su masa es 2 veces menor que los productos de cobre correspondientes.Teniendo en cuenta la resistencia a la corrosión del aluminio, sefabricar partes de aparatos y recipientes para ácido nítrico . El polvo de aluminio es la base en la fabricación de pintura de plata para proteger los productos de hierro de la corrosión, así como para reflejar los rayos de calor, dicha pintura se utiliza para cubrir las instalaciones de almacenamiento de petróleo y los trajes de los bomberos.El óxido de aluminio se utiliza para producir aluminio y también como material refractario.El hidróxido de aluminio es el componente principal de los conocidos medicamentos Maalox, Almagel, que reducen la acidez del jugo gástrico. Las sales de aluminio están altamente hidrolizadas. Esta propiedad utilizado en el proceso de purificación del agua. Al agua a purificar se le añade sulfato de aluminio y una pequeña cantidad de cal apagada para neutralizar el ácido resultante. Como resultado, se libera un precipitado volumétrico de hidróxido de aluminio que, al sedimentarse, lleva consigo partículas suspendidas de turbidez y bacterias.Así, el sulfato de aluminio es un coagulante.6. Obtención de aluminio 1) El método moderno y rentable para producir aluminio fue inventado por el estadounidense Hall y el francés Héroux en 1886. Consiste en la electrólisis de una solución de óxido de aluminio en criolita fundida. Criolita fundida Na 3 AlF 6 disuelve Al 2 O 3, cómo el agua disuelve el azúcar. La electrólisis de una "solución" de óxido de aluminio en criolita fundida procede como si la criolita fuera solo un disolvente y el óxido de aluminio fuera un electrolito. 2Al 2 O 3 corriente eléctrica → 4Al + 3O 2 En la "Enciclopedia para niños y niñas" en inglés comienza un artículo sobre el aluminio. siguientes palabras: “El 23 de febrero de 1886, comenzó una nueva era de los metales en la historia de la civilización: la era del aluminio. Tal día como hoy, Charles Hall, un químico de 22 años, se presentó en el laboratorio de su primer maestro con una docena de pequeñas bolas de aluminio blanco plateado en la mano y con la noticia de que había encontrado una forma de fabricar este metal. barato y en grandes cantidades". Así que Hall se convirtió en el fundador de la industria estadounidense del aluminio y en un héroe nacional anglosajón, como un hombre que hizo de la ciencia un gran negocio. 2) 2Al 2 O 3 + 3 C \u003d 4 Al + 3 CO 2 ES INTERESANTE:
- El aluminio metálico fue aislado por primera vez en 1825 por el físico danés Hans Christian Oersted. Al pasar cloro gaseoso a través de una capa de alúmina caliente mezclada con carbón, Oersted aisló el cloruro de aluminio sin el menor rastro de humedad. Para restaurar el aluminio metálico, Oersted necesitaba tratar el cloruro de aluminio con amalgama de potasio. Después de 2 años, el químico alemán Friedrich Wöller. Mejoró el método reemplazando la amalgama de potasio con potasio puro.
En los siglos XVIII y XIX, el aluminio era el principal metal de joyería. En 1889, D. I. Mendeleev en Londres fue premiado por sus servicios en el desarrollo de la química. regalo valioso– balanzas de oro y aluminio.
En 1855, el científico francés Saint-Clair Deville había desarrollado un proceso para producir aluminio metálico a escala industrial. Pero el método era muy caro. Deville disfrutó del patrocinio especial de Napoleón III, emperador de Francia. Como muestra de su devoción y gratitud, Deville hizo para el hijo de Napoleón, el príncipe recién nacido, un sonajero elegantemente grabado, el primer "producto de consumo" hecho de aluminio. Napoleón incluso tuvo la intención de equipar a sus guardias con corazas de aluminio, pero el precio era prohibitivo. En ese momento, 1 kg de aluminio costaba 1000 marcos, es decir 5 veces más caro que la plata. No fue hasta la invención del proceso electrolítico que el aluminio se volvió tan valioso como los metales convencionales.
¿Sabía que el aluminio, al ingresar al cuerpo humano, causa un trastorno del sistema nervioso? Con su exceso, se altera el metabolismo. PERO equipo de proteccion es vitamina C, calcio, compuestos de zinc.
Cuando el aluminio se quema en oxígeno y flúor, se libera mucho calor. Por lo tanto, se utiliza como aditivo para el combustible de cohetes. El cohete Saturno quema 36 toneladas de polvo de aluminio durante su vuelo. La idea de usar metales como componente del combustible para cohetes fue propuesta por primera vez por F.A. Zander.
¡Pensar! ¿Por qué esta reacción no se puede llevar a cabo en una solución acuosa? №2. Completa las ecuaciones de las reacciones químicas:
Al + H 2 SO 4 (solución) ->
Al+CuCl2 ->
Al + HNO 3 (conc) - t ->
Al + NaOH + H 2 O -> No. 3. Resuelve el problema:
Una aleación de aluminio y cobre se expuso a un exceso de solución concentrada de hidróxido de sodio mientras se calentaba. Se liberaron 2,24 litros de gas (n.o.s.). Calcular la composición porcentual de la aleación si peso total eran 10 g?4. Tarea Nota: se puede usar una presentación en la lección"Aluminio. La posición del aluminio en el sistema periódico y la estructura de su átomo. Encontrar en la naturaleza. Propiedades físicas y químicas del aluminio.»








