Конспект урока по теме
«Алюминий»
Цели:
n Дать представление о строении атома алюминия на основании его положения в ПСХЭ, о физических и химических свойствах простого вещества алюминия и его нахождении в природе
n Обобщить знания учащихся о применении алюминия, его соединений и сплавов в народном хозяйстве
n Обсудить значение алюминия в организме человека
7) Применение алюминия и его соединений (обобщение знаний, проверка записей конспекта)
Игра: выберите предметы, сделанные из алюминия и объясните какие свойства использовал человек при их изготовлении
- конструкционный материал (лёгкость, податливость штамповке, коррозионная стойкость); производство кухонной посуды, алюминиевой фольги (нетоксичен, высокая теплопроводность);
· изготовление проводов (лёгкость, электропроводность). Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 2 раза дешевле. Правда, у алюминия как электротехнического материала есть неприятное свойство - из-за прочной оксидной плёнки его тяжело паять;
- изготовления зеркал (высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления); ювелирные изделия (когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии); алюминий зарегистрирован в качестве пищевой добавки Е173 (группа красителей); высокоэффективное ракетное горючее; краска «серебрянка» (блеск в порошке); восстанавливает металлы из их оксидов (алюминотермия); хлорид алюминия AlCl3 применяют в качестве катализатора (?) в производстве очень многих органических веществ
8) Алюминий в организме человека
В организм человека ежесуточно поступает от 5 до 50 мг алюминия
При горячей обработке пищевых продуктов за счёт использования алюминиевой посуды, происходит загрязнение пищи этим металлом
Алюминий также поступает в организм с пищей, питьевой водой , через лёгкие, с лекарственными препаратами, дезодорантами
Депонируется в костях, печени, лёгких и сером веществе головного мозга
С возрастом содержание алюминия в лёгких и головном мозге увеличивается
Внимание! Опасность! В больших концентрациях алюминий отрицательно действует на нервную систему и может вызвать судороги, снижение или потерю памяти, способствует развитию старческого атеросклероза , у детей замедляется развитие, поражается желудок, кишечник. В этом случае помогут крапива, хвощ полевой, препараты, содержащие янтарную кислоту.
Раздатка для родителей: «Алюминий является постоянной составной частью клеток. В небольших количествах он необходим человеку, но в случае избытка этот металл может представлять серьёзную опасность для здоровья. Алюминий попадает в организм с пищей, водой, дезодорантами, из алюминиевой посуды. Поэтому хранить и готовить в такой посуде молочные блюда, щи, компоты, солёную рыбу, маринованные овощи и грибы, квашеную капусту нельзя, так как в кислой среде алюминий постепенно растворяется и частично переходит в продукты».
4. Закрепление полученных знаний
1) Тест с взаимопроверкой «Какие утверждения верны?»
1. Алюминий встречается в природе только в виде соединений (+)
2. Силумин – сплав алюминия с серой (-)
3. Атомы алюминия проявляют восстановительные свойства (+)
4. Алюминий плохо проводит электричество (-)
5. Алюминий может реагировать как с кислотами, так и со щелочами (+)
6. В случае избытка алюминий может представлять серьёзную опасность для здоровья (+)
7. Мировое производство алюминия постоянно уменьшается (-)
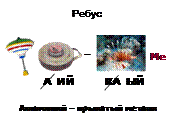
2) Отгадайте ребус:
Обязательное: § 13 стр. 68-74, ? 1, 4 стр. 75, закончите конспект урока
Дополнительное: 1) Запишите уравнения химических реакций взаимодействия алюминия с бромом, серой и углеродом. Рассмотрите их с точки зрения ОВР. 2) ? 5 стр.75
Творческое: написал в 1959 году стихотворение «Осень», в котором использовал алюминий в качестве художественного образа:…А за окошком в юном инее лежат поля из алюминия… Объясните, какие свойства алюминия подразумевал поэт. Придумайте красивые образные выражения с использованием свойств алюминия, которые можно использовать при написании сочинений.
6. Окончание урока
7. Рефлексия
Источники информации:
1. Габриелян, . 9 класс: учеб. Для общеобразоват. учреждений / . – М.: Дрофа, 2008. – 270 с.
2. Акопян, В. Не всё хорошо, что блестит (статья) / В. Акопян // Вестник ЗОЖ. – 2004. - №1.
3. http://ru. wikipedia. org/wiki/ - алюминий, природные соединения и сплавы алюминия и их применение
4. http://**/naz_factory. aspx - Надвоицкий алюминиевый завод
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий - металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3s 2 3p 1 . При химических взаимодействиях в возбужденном состоянии он способен образовывать три ковалентных связи или полностью отдавать свои три электроны, проявляя в своих соединениях степень окисления +3. Следовательно, Алюминий является активным восстановителем.
Алюминий по распространенности занимает третье место среди других элементов. Массовая доля Алюминия в земной коре составляет 8,5 %. В природе он встречается только в виде соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды, полевые шпаты, в частности каолин. Промышленно важным алюминиевой рудой являются боксит Al 2 O 3 · n Н 2 О. Алюминий входит в состав минерала корунда, который является кристаллическим алюминий оксидом Al 2 O 3 . Различные примеси способны оказывать корундовые разных цветов. зеленого, желтого, оранжевого, фиолетового и других цветов и оттенков. Его синий разновидность называют сапфиром, а красный - рубином. И рубины, и сапфиры являются драгоценными камнями.
Простое вещество алюминий - блестящий серебристо-белый металл. Он имеет высокую способность отражать световые и тепловые лучи, а также высокие тепло - и электропроводность. Температура плавления алюминия 660 °С. Это достаточно легкий и пластичный металл. С него можно производить тонкую проволоку и фольгу.
Химически алюминий очень активный. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и предопределяет коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:
4Al + 3O 2 = 2Al 2 O 3 .
Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:
2Al + 3Сl 2 = 2AlСl 3 .
Реакция алюминия с йодом происходит, если к смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:
2Al + 3I 2 = 2AlІ 3 .
При нагревании алюминий реагирует с серой, азотом, углеродом, например:
2Al + 3S = Al 2 S 3 .
В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к воздействию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газуватого водорода:
2Al + 6Н 2 О = 2Al(ОН) 3 ↓ + 3Н 2 .
Алюминий реагирует с растворами кислот с образованием солей и водорода, например:
2Al + 6НСl= 2AlCl 3 + 3Н 2 .
Концентрированные сульфатная и азотная кислоты пассивируют алюминий, то есть увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.
Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:
2Al + 2NaOH +6Н 2 O = 2Na + 3Н 2 .
Алюминий восстанавливает металлы из их оксидов при нагревании (алюмінотермія), например:
Fe 2 O 3 + 2Al = 2Fe + Al 2 O 3 .
Алюминий добывают путем электролиза глинозема, растворенного в расплавленном криолите Na 3 .
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.п. Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготавливают зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используют как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
Алюминий - металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3s23p1. При химических взаимодействиях в возбужденном состоянии он способен образовывать три ковалентных связи
или полностью отдавать свои три электрона, проявляя в своих соединениях степень окисления +3. Итак, Алюминий является активным восстановителем.
Алюминий по распространенности занимает третье место среди других элементов. Массовая доля алюминия в земной коре составляет 8,5%. В природе он встречается только в виде соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды, полевые шпаты, в частности каолин. Промышленно важным алюминиевой рудой являются боксит Al2O3 nН2О. Алюминий входит в состав минерала корунда, который является кристаллическим алюминий оксидом Al2O3. Различные примеси способны оказывать корундовые разных цветов. зеленого, желтого, оранжевого, фиолетового и других цветов и оттенков. Его синяя разновидность называют сапфиром, а красный - рубином. И рубины, и сапфиры являются драгоценными камнями.
Простое вещество алюминий - блестящий серебристо-белый металл. Он обладает высокой способностью отражать световые и тепловые лучи, а также высокие тепло-и электропроводность. Температура плавления алюминия 660 ° С. Это достаточно легкий и пластичный металл. Из него можно производить тонкую проволоку и фольгу.
Химически алюминий очень активен. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и вызывает коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:
4Al + 3O2 = 2Al2O3.
Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:
2Al + 3Сl2 = 2AlСl3.
Реакция алюминия с йодом происходит, если в смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:
2Al + 3I2 = 2AlИ3.
При нагревании алюминий реагирует с серой, азотом, углеродом, например:
2Al + 3S = Al2S3.
В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к действию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газообразного водорода:
2Al + 6Н2О = 2Al (OH) 3 ? + 3Н2 ?.
Алюминий реагирует с растворами кислот с образованием солей и водорода, например:
2Al + 6НСl = 2AlCl3 + 3Н2 ?.
Концентрированные серная и нитратная кислоты пассивируют алюминий, т.е. увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.
Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:
2Al + 2NaOH +6 Н2O = 2Na + 3Н2 ?.
Алюминий восстанавливает металлы из их оксидов при нагревании (Алюминотермия), например:
Fe2O3 + 2Al = 2Fe + Al2O3.
Алюминий добывают путем электролиза глинозема растворенного в расплавленном криолите Na3 .
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.д.. Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготовляют зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используется как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
Физические свойства :
Общие химические свойства
|
I А группа |
II А группа |
алюминий |
|
|
4 Na + О 2 = 2 Na 2 O |
2 Ca + О 2 = 2 CaO | ||
|
Na + Cl 2 = 2 NaCl |
Ca + Cl 2 = CaCl 2 |
2Al + 3Cl 2 = 2 AlCl 3 |
|
|
2 Na + 2Н 2 О = 2 NaOН + Н 2 |
Са+ 2Н 2 О = Сa(OН) 2 + Н 2 |
2Аl +6H 2 O=2Al(OH) 3 + 3H 2 (очищенный от оксидной пленки) |
Встречаемость в природе
Применение
|
I А группа |
II А группа |
Алюминий |
|
1.Для фейерверков 2. В пищевой промышленности 3. Получение Металлов, Щелочей этих металлов (едкого натра и калия), Калийные удобрения, сильвинит, В медицине, Производство соды |
Соединения элементов группы применяются 1. Для фейерверков 2. В медицине (хлористый кальций и магний, магнезия) 3. Производство строительных вяжущих материалов 4. Получение металлов 5. Получение известковой, баритовой воды 6. Производство минеральных удобрений |
1.Строительство 2.Судостроение 3.Упаковочный материал 4. Химическое машиностроение 5.Ракетостроение 6.Производство пеноалюминия 7.Провода электропередач 8.Самолетостроение 9.Автомобильная промышленность 10.Производство посуды |
Закрепление и проверка знаний Контрольные вопросы
Перечислите щелочные металлы. Почему они так называются?
Каковы особенности строения атомов щелочных металлов?
Какова степень окисления щелочного металла в соединении? Почему?
Каковы физические свойства щелочных металлов?
Какой из щелочных металлов наиболее активен и почему?
Какие реакции характерны для щелочных металлов?
Какие оксиды и пероксиды получаются при окислении щелочных металлов?
Как окрашивают пламя атомы и ионы щелочных металлов?
Какие химические связи образуют щелочные металлы с неметаллами?
Как можно получить щелочные металлы?
Где применяются щелочные металлы?
Какие элементы образуют щелочноземельных металлов?
Где в периодической системе расположены эти элементы?
Каковы особенности строения атомов этих металлов?
Какая степень окисления характерна щелочно-емельных элементов в соединениях?
Каковы физические свойства кальция, магния?
Как нужно хранить эти металлы?
Как можно получить эти металлы?
Перечислите реакции, характерные для этих металлов.
Каково строение атома алюминия?
Какова степень окисления алюминия в соединениях? Почему?
Назовите важнейшие природные соединения алюминия.
Каковы физические свойства алюминия?
Как ведет себя алюминий в химических реакциях? Почему?
С какими кислотами алюминий не взаимодействует?
Как алюминий взаимодействует с щелочами?
Какие металлы алюминий может восстановить из солей или оксидов?
Какие реакции доказывают амфотерность оксида и гидроксида алюминия?
Что происходит с гидроксидом алюминия при нагревании?








